Stereokemija intrinzičnega nereda
V današnjem Znanstvenem britOFFu poročamo o raziskavi danskih raziskovalcev, ki razgrinja zanimive vidike stereokemijskih značilnosti prepoznave intrinzično neurejenih proteinov. Raziskavo so objavili konec novembra v reviji Nature.
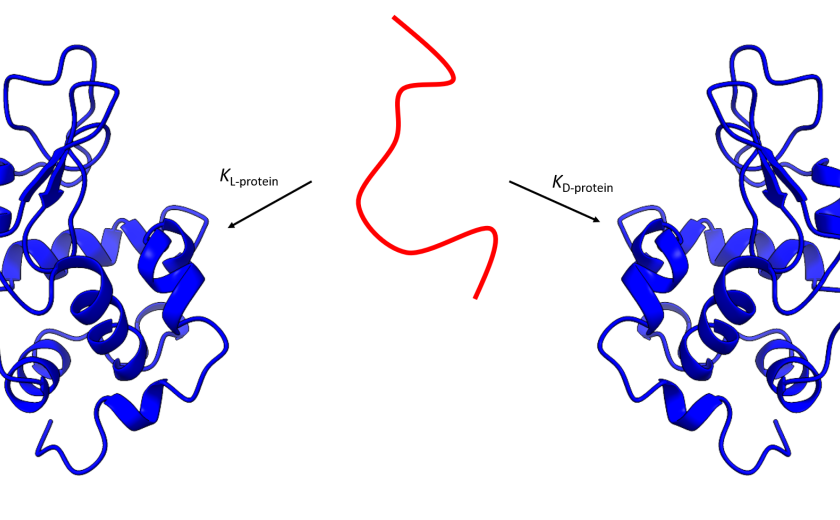
Vsak izmed osnovnih gradnikov proteina, to so aminokisline, lahko obstaja v dveh stereokemijskih oblikah. Ti dve obliki, imenujemo ju tudi enantiomera, se razlikujeta po razporeditvi funkcionalnih skupin okoli centralnega ogljikovega atoma. Okrog slednjega so namreč razporejene štiri različne funkcionalne skupine. V principu to pomeni, da sta dve enantiomerni molekuli ena drugi zrcalni sliki, L- in D- oblike. Iz še nepojasnjenih razlogov najdemo v naravi skoraj izključno takšne proteine, ki so zgrajeni iz L-aminokislin. To ima pomembne posledice. Zaradi svoje edinstvene prostorske strukture, ki jih proteini zavzamejo, lahko proteini prepoznajo zgolj tiste vezavne partnerje, ki so prav tako zgrajeni iz L-aminokislin. Povedano drugače, pravimo, da so protein stereospecifični.
Dansko raziskovalno skupino je zanimalo, ali to sicer dobro uveljavljeno dejstvo obvelja tudi za sicer veliko skupino proteinov, za katero je značilna strukturna neurejenost – to so intrinzično neurejeni proteini. Za slednje je značilna visoka neurejenost in dinamičnost nativnega nevezanega stanja. Ob tvorbi kompleksa z drugim vezavnim partnerskim proteinom se lahko intrinzično nerurejeni protein bodisi uredi, strukturira ali pa ohrani svoj nestrukturiran dinamični značaj.
Raziskovalci so si izbrali pet različnih primerov interakcij, ki se razlikujejo po stopnji dinamičnosti intrinzično neurejenega proteina v vezanem stanju – od takšnega, ki se v vezanem stanju uredi v jasno prostorsko strukturo, do takšnega, ki ostane v vezanem stanju neurejen. Za vsak primer so pripravili dve enantiomerni različici proteina, torej takšnega iz L-aminokislin ter takšnega iz D-aminokislin.
Z uporabo spektroskopskih in kalorimetričnih metod so nato določili vezavne lastnosti posameznih parov proteinov. Zanimivo, a morda niti ne tako presenetljivo, so raziskovalci med posameznimi pari proteinov opazili znatne razlike. Pri kompleksih, kjer se intrinzično neurejeni proteini ob vezanju na tarčni protein uredijo v jasno opredeljeno prostorsko zgradbo, so pričakovano izmerili občutno slabše vezavne lastnosti D-enantiomernih različic proteina. Na drugi strani so pri proteinih, ki ostanejo visokodinamični v kompleksu, opazili, da ti med L- in D-enantiomerom pravzaprav sploh ne razlikujejo. Izmerjene vezavne lastnosti so bile namreč enake.
Raziskava je izpostavila pomembne, temeljne razlike pri interakcijah med intrinzično neurejenimi proteini, hkrati pa je tudi ponudila zanimivo izhodišče za razvoj novih učinkovin na osnovi različne stereospecifičnosti.
Vir: Newcombe, E.A., Due, A.D., Sottini, A. et al. Stereochemistry in the disorder–order continuum of protein interactions. Nature (2024). https://doi.org/10.1038/s41586-024-08271-6









Dodaj komentar
Komentiraj