Urejeni nered
Pozdravljeni v oddaji Frequenza della Scienza na valovih Radia Študent. V današnji oddaji se bomo posvetili molekulam življenja – proteinom. Proteini so glavni izvajalci nalog v celicah. Sodelujejo pri večini bioloških procesov in so vpleteni v raznolike dejavnosti, kot so razmnoževanje, rast, proizvajanje energetsko bogatih molekul, premikanje po prostoru, obramba pred patogeni in neštete druge. To skoraj neomejeno možnost sodelovanja v številnih procesih znotraj celice proteinom omogoča njihova zmožnost oblikovanja v praktično neskončno različnih struktur.
Na molekulskem nivoju si lahko proteine poenostavljeno predstavljamo kot biserno ogrlico, pri kateri je vsak biser svoj aminokislinski ostanek. Čeprav so gradniki proteinov aminokisline, se jim, ko se skupaj povežejo v protein, delno spremeni fizikalnokemijski značaj, zato jih v kontekstu proteina označujemo z aminokislinskimi ostanki namesto z aminokislinami. To, kako se bo proteinska ogrlica oblikovala oziroma zvila v prostoru, je odvisno od določenih aminokislinskih ostankov, ki gradijo ogrlico, ter od fizikalnokemijskih lastnosti okolja, v katerem se protein nahaja. Kot bomo spoznali v današnji oddaji, je ključ do razumevanja delovanja proteinov prav v razumevanju njihove oblike.
Klasično razumevanje delovanja proteinov je sledilo enačbi: en protein zajema eno urejeno strukturo, kar mu omogoča opravljanje ene določene funkcije. A ta zastarel pogled se počasi umika bolj dinamičnemu razumevanju zgradbe in delovanja proteinov. Veliko celičnih proteinov namreč ne zavzame zgolj ene oblike, temveč je njegova zgradba bolj plastična in dinamična.
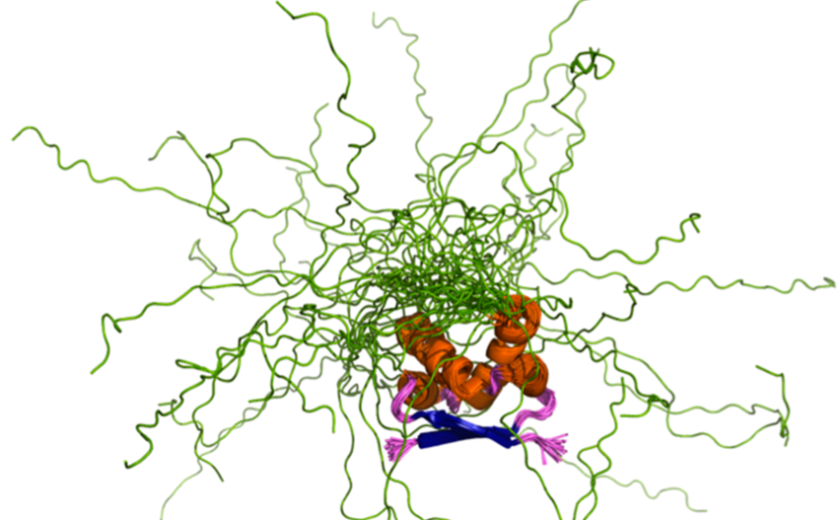
Nekateri proteini ne zavzamejo jasne oblike in ostanejo neurejeni, gibljivi ter konstantno spreminjajo obliko. Znanstveniki in znanstvenice vse bolj ugotavljajo, da odsotnost jasno definirane tridimenzionalne strukture ni znak njihove nefunkcionalnosti, temveč je to intrinzična lastnost določene skupine proteinov. Neurejenost namreč omogoča prilagajanje na spremembe v okolju ter izvajanje nalog, ki jih proteini v pretežno statični obliki ne bi mogli opravljati.
V današnji oddaji se bomo poglobili v svet tako imenovanih intrinzično neurejenih proteinov - to so proteini, ki nimajo urejene, strukturirane oblike. Posvetili se bomo vprašanjema, kako se takšni proteini obnašajo in kako je njihovo odkritje spremenilo naše razumevanje delovanja vseh proteinov.
Začnimo današnjo zgodbo na začetku, torej pri rojstvu proteina v celici. Navodila za sestavo vseh celičnih proteinov so zapisana v zaporedju DNK v genomu organizma. Po tem, ko se genetska informacija iz DNK prenese na sporočilno molekulo RNK, se ta na ribosomu prevede v nizajoče se zaporedje aminokislinskih ostankov v polipeptidni verigi - to je v proteinu. Vsi celični proteini so zgrajeni iz samo dvajsetih aminokislinskih ostankov, vendar je število njihovih možnih kombinacij v polipeptidnih verigah praktično neskončno.
Vsak aminokislinski ostanek ima svoje značilne fizikalnokemijske lastnosti. Aminokislinski ostanki se tako med seboj razlikujejo po porazdelitvi električnega naboja, po hidrofilnosti oziroma hidrofobnosti ter po tem, ali v vodni raztopini delujejo kot kislina ali baza. Prav tako je pomembna sama oblika aminokislinskih gradnikov – nekateri imajo velike stranske molekulske skupine, medtem ko imajo drugi manjše skupine in posledično zavzamejo manj prostora. Fizikalnokemijske značilnosti aminokislinskih ostankov so odgovorne za privlačne in odbojne sile ter strukturne omejitve, ki bodo skupaj pomembno določale, kako se bo polipeptidna veriga lahko oblikovala v okolju.
Ko polipeptidna veriga zapusti ribosom, ta zavzame energijsko najugodnejšo obliko. To določajo tako interakcije med atomi aminokisline kot tudi interakcije z molekulami topila, torej vode. Profesor Vladimir Uversky z Univerze Južne Floride nam pojasni, katere interakcije določajo, kako se bo zvila polipeptidna veriga. Profesor Uversky je eden izmed pionirjev na področju intrinzično neurejenih proteinov in je pomembno prispeval tako k razumevanju fizikalnega ozadja ter opisa njihovega obnašanja kot tudi k bioinformatski primerjalni analizi proteomov, torej vseh proteinov, ki so zakodirani v genomu nekega organizma.
Izjava
Interakcije med aminokislinskimi ostanki in okoliškim topilom določajo končno obliko proteina. Globularni proteini – tako jim pravimo, ker njihova oblika spominja na kroglo – zavzamejo kompaktno strukturo. To je predvsem posledica visoke vsebnosti hidrofobnih aminokislinskih ostankov, ki se odmaknejo okoliški vodi in zakopljejo v sredico proteina.
Raziskovalke in raziskovalci so odkrili, da številni proteini ne tvorijo takšne kompaktne tridimenzionalne strukture, ampak so v svojem nativnem stanju neurejeni. Ker je njihovo naravno stanje nestrukturirano, so jih znanstvenice in znanstveniki poimenovali intrinzično neurejeni proteini, v angleščini imenovani s kratico IDPs. Razlike med urejenimi strukturiranimi in intrinzično neurejenimi proteini nam je pojasnila tudi profesorica Jane Dyson, priznana raziskovalka s Scrippsovega inštituta v San Diegu, ki je s svojimi strukturnobiološkimi študijami razkrila biološko vlogo številnih pomembnih proteinov, ki jih danes uvrščamo med intrinzično neurejene proteine.
Izjava
Za strukturno neurejene dele je tako značilna odsotnost hidrofobnih aminokislinskih ostankov, ki so sicer pri globularnih proteinih odgovorni za tvorbo hidrofobne sredice in s tem kompaktne strukture. Po drugi strani je za intrinzično neurejene proteine značilna večja vsebnost polarnih aminokislinskih ostankov, ki nimajo težnje po odmiku od okoliškega topila - vode. Nestrukturiranost je pri intrinzično neurejenih proteinih tako značilnost aminokislinskega zaporedja in je torej določena že z nukleotidnim zaporedjem v DNK.
Sledi krajši glasbeni premor, po katerem bomo nadaljevali z opisom metod, s katerimi analiziramo zgradbo intrinzično neurejenih proteinov.
Vmesni komad: Cocteau twins - Iceblink luck
Poslušate oddajo Frequenza della scienza, v kateri danes govorimo o zgradbi proteinov, pri čemer se bolj podrobno posvečamo intrinzično neurejenim proteinom.
Kot nam je pojasnila profesorica Jane Dyson s Scrippsovega inštituta v Kaliforniji, intrinzično neurejenih proteinov ne opiše ena sama statična tridimenzionalna struktura, temveč več struktur - strukturni ansambel, sestavljen iz različnih konformacij molekule, ki se v raztopini dinamično preklapljajo. Profesorica Dyson nam razloži, da takšnih proteinov zaradi njihove večje strukturne dinamičnosti ne moremo opazovati s tradicionalnimi strukturnobiološkimi metodami, kot sta denimo rentgenska strukturna analiza in krioelektronska mikroskopija, ki temeljita na analizi trdnega vzorca proteina.
Izjava
Nuklearna magnetna resonanca, krajše NMR, nam omogoča edinstven vpogled v dinamiko nestrukturiranih proteinov, ki je z drugimi strukturnobiološkimi metodami nedostopna. Z NMR lahko namreč – za razliko od ostalih tehnik – opazujemo spreminjanje konformacij molekul v raztopini. Tehnika temelji na lastnosti atomskih jeder, da imajo svoj magnetni moment in se tako obnašajo kot majhni magneti. Z manipuliranjem jedrskih magnetnih momentov v močnem induciranem magnetnem polju lahko s tehniko NMR določimo razdalje med atomi proteina v prostoru in tako natančno določimo atomsko tridimenzionalno strukturo opazovane molekule proteina.
Razvoj tehnik za opazovanje struktur molekul je pomembno vplival tudi na razumevanje povezave med biološko funkcijo proteinov in njihovo strukturo. Rentgenska strukturna analiza je že v petdesetih letih prejšnjega stoletja omogočila določitev atomske zgradbe DNK, kmalu zatem pa tudi že nekaterih večjih proteinov, pri čemer so prevladovali strukturirani globularni proteini, med katerimi najdemo številne encime. Encimi so proteini, ki pospešijo kemijske reakcije, tako da vežejo substrate in omogočijo hitrejši nastanek produkta.
Zaradi svoje vloge, ki zahteva vezavo in natančno prepoznavo substratov, so encimi povečini strukturirani proteini. V znanstveni skupnosti se je v začetnem obdobju strukturne biologije, ki je takrat temeljila predvsem na uspehu določitve kristalnih struktur proteinov z rentgensko strukturno analizo, uveljavila tako imenovana paradigma o povezavi med strukturo in funkcijo proteina.
Izjava
Med znanstveniki in znanstvenicami je torej dolgo časa veljalo trdno prepričanje o povezavi med aminokislinskim zaporedjem proteina, njegovo jasno tridimenzionalno strukturo in točno določeno funkcijo tega proteina, kar povzema opisana paradigma.
Intrinzično neurejeni proteini so bili odkriti šele potem, ko se je že uveljavila paradigma o povezavi strukture in funkcije proteina. Njihovo odkritje je tako zamajalo miselne premise, ki jih je zajemala prej uveljavljena paradigma. Profesorica Dyson nam je pojasnila, zakaj so bili intrinzično neurejeni proteini tako dolgo spregledani.
Izjava
Lahko bi rekli, da so se intrinzično neurejeni proteini, čeravno so vedno prisotni, skrivali v neuspešnih izolacijah oziroma nasploh v neuspelih eksperimentih številnih znanstvenikov in znanstvenic, ki so skušali preučevati določene proteine.
Odkritje, da je v genomu zapisanih veliko proteinov, ki ne ustrezajo povezavi med fiksno tridimenzionalno strukturo proteina in njegovo funkcijo, je tako prišlo predvsem z razvojem genomike in določitvijo genomskih zaporedij. Takrat so raziskovalci in raziskovalke spoznali, da številni proteini vsebujejo regije, ki ne morejo zavzeti jasne tridimenzionalne strukture in so tako v svojem naravnem stanju strukturno neurejene.
Znanstveniki in znanstvenice so analizirali proteinska zaporedja iz številnih živih organizmov in primerjali vsebnost intrinzično neurejenih proteinov. Prišli so do zanimivega spoznanja, da kompleksnejši evkariontski organizmi – to so tisti, katerih dednina je organizirana znotraj celičnega jedra – vsebujejo večji delež neurejenih proteinov od enostavnejših prokariontskih organizmov, kot so denimo bakterije. Kako lahko razložimo takšne razlike, nam je povedal profesor Vladimir Uversky.
Izjava
Profesorja Uverskyja smo povprašali tudi o evolucijski zgodovini nestrukturiranosti proteinov. Ali so proteomi od nekdaj vsebovali intrinzično neurejene proteine ali so se ti pojavili kasneje v razvoju? Postajajo proteomi vse bolj ali vse manj strukturirani?
Izjava
Na začetku je v primordialni juhi, v kateri so se kompleksnejše biološke makromolekule šele formirale, v svetu proteinov vladal strukturni nered, ki so ga narekovali ostri fizikalnokemijski pogoji. Kasneje, ko so se izoblikovale prve celice, se je povečala težnja po oblikovanju strukturiranih encimov, ki bi celici priskrbeli življenjsko potrebne surovine. Ob oblikovanju kompleksnejših evkariontskih celic so se pojavile dodatne potrebe po natančni regulaciji in signalizaciji, kar lahko razloži opazno naraščanje nestrukturiranosti v proteomu.
Med organizmi opazimo različno vsebnost strukturnega nereda, ki korelira s kompleksnostjo organizma. To nakazuje, da so intrinzično neurejeni proteini specializirani za določena kompleksnejša opravila znotraj celic. Bioinformatske analize kažejo, da je v človeškem genomu kar 40 odstotkov proteinov, ki vsebujejo znatni delež intrinzično nestrukturiranih regij. Številne strukturne študije in bioinformatske analize sekvenc proteomov so pokazale na še posebej pomembno vlogo intrinzično neurejenih proteinov v kompleksnejših celičnih procesih, kot sta denimo prenos signala in uravnavanje celičnega cikla, opisuje profesorica Jane Dyson.
Izjava
Strukturna plastičnost, ki je posledica nestrukturiranosti proteinov oziroma njihovih delov, tako razširja funkcionalni repertoar proteina. Ta lahko zaradi svoje prilagodljive oblike sodeluje v različnih signalnih poteh in celičnih procesih, ne le v enem. Pri vseh procesih seveda igrajo ključno vlogo interakcije z drugimi proteini.
Preden nadaljujemo z opisom vlog intrinzično neurejenih proteinov v celicah, pa si privoščimo še en glasbeni premor.
Vmesni komad: Weyes Blood - Everyda
Nadaljujemo s tokratno oddajo Frequenza della scienza na frekvenci 89,3 megahertza, v kateri se ukvarjamo z intrinzično neurejenimi proteini in tem, kakšno vlogo imajo v celicah.
Interakcije med strukturiranimi proteini dobro opiše tako imenovani model ključa in ključavnice, ki ga je že leta 1893 opisal nemški kemik Emil Fisher, ko je preučeval vezanje substrata na encime. Proteina, ki med seboj prideta v medsebojno interakcijo, imata na svoji površini izoblikovani vezavni mesti, ki se strukturno ujemata, kar pomeni, da sta komplementarni. Prileganje dveh proteinov so tako simbolično primerjali s prileganjem ključa ključavnici, pri tej analogiji pa je pomembna specifičnost določenega ključa za odklepanje točno določene ključavnice. Kako pa izgledajo interakcije med intrinzično neurejenimi proteini, ki nimajo stalne tridimenzionalne strukture? Različne načine medmolekularne prepoznave med intrinzično neurejenimi proteini je opisala profesorica Jane Dyson.
Izjava
Intrinzično neurejeni protein se lahko torej ob vezavi na drugi protein zvije ali pa ne. V primeru, ko se intrinzično neurejeni protein ob vezavi na partnerski protein zvije, to prispeva k večji specifičnosti interakcije. Nekateri izmed intrinzično neurejenih proteinov pa se ob vezanju ne zvijejo, ampak ohranijo strukturno dinamičnost - takšne interakcije imenujemo tudi »fuzzy interakcije«. Kot je razložila profesorica Dyson, to omogoči, da so interakcije manj specifične. To je denimo še posebej pomembno pri procesiranju signalov znotraj celice.
Za konec omenimo, da intrinzično neurejeni proteini igrajo pomembno vlogo v nekaterih procesih, ki jih raziskovalci in raziskovalke šele začenjajo raziskovati in razumeti. Eden izmed takšnih procesov je denimo fazna ločitev tekoče-tekoče. Pri omenjenem procesu proteini z intrinzično neurejenimi deli skupaj z drugimi celičnimi proteini ustvarijo kapljico znotraj citoplazme. Takšna kapljica predstavlja nekakšen organel, ki pa za razliko od drugih celičnih organelov ni razmejen z lipidno membrano - torej gre za nemembranski organel. Kapljice, ki jih razmejujejo proteini z intrinzično neurejenimi regijami, vsebujejo številne proteine, pomembne za določen proces v celici. Fenomen fazne ločitve tekoče-tekoče, ki vodi v nastanek nemembranskega organela, opiše Vladimir Uversky.
Izjava
Intrinzično neurejeni proteini lahko s svojimi interakcijami z ostalimi proteini povzročijo fazno separacijo in nastanek zelo dinamičnih kapljic znotraj celic, v katerih vladajo lokalni fizikalnokemijski pogoji, ki kapljico ločijo od ostale citoplazme. Področje fazne separacije tekoče-tekoče je zelo vroče raziskovalno področje: kot nam pojasni profesor Uversky, raziskovalci in raziskovalke praktično vsak mesec poročajo o novih nemembranskih skupkih, o kapljicah znotraj celic. O enem izmed takšnih nemembranskih organelov smo nedavno že poročali na znanstvenih valovih Radia Študent.
Odkritje intrinzično neurejenih proteinov je šele nedavno razkrilo kompleksnost odnosov med strukturo in funkcijo bioloških makromolekul. Številne strukturne študije danes kažejo, da so molekularne komponente življenja zelo dinamične strukture. Strukturni nered, kot ga opazimo pri intrinzično neurejnih proteinih, ne predstavlja zgolj dodatne sporadične kompleksnosti življenja, ampak ima tudi pomembno vlogo v številnih celičnih procesih, ki jih s podrobnim preučevanjem teh proteinov in procesov, v katere so vpleteni, šele začenjamo dobro razumeti.
Oddajo sta pripravila Uroš in Arne.
Brali sva Pia in Polona.
Tehniciral je Blaž.
Lektorirala je Nataša.










Dodaj komentar
Komentiraj