Tekočetekoče
Pozdravljeni v oddaji Frequenza della scienza. Danes se bomo posvetili nekoliko bolj posebnim in ne prav dobro poznanim celičnim strukturam, ki pa, kot boste spoznali v oddaji, igrajo zelo pomembno vlogo v številnih življenjskih procesih. Njihova deregulacija pa lahko povzroči številne patologije in bolezni. Natančneje, govorili bomo o pojavu fazne ločitve tekoče-tekoče med biološkimi makromolekulami ter o nastanku tako imenovanih biomolekularnih kondenzatov oziroma nemembranskih organelov.
Organiziranost celične notranjščine po uveljavljenem pogledu sestoji iz tako imenovanih kompartmentov oziroma znotrajceličnih organelov, ki jih od okolice ločuje lipidna membrana. Takšni organeli so mitohondriji, celično jedro, Golgijev aparat, lizosom, endoplazemski retikulum, vakuola pa tudi različni vezikli. Razmejitev takšnih organelov z lipidno membrano je ključna za njihovo funkcijo, saj omogoča fizično ločitev določenega celičnega procesa od preostalega celičnega džumbusa. Poleg tega proteini, ki so zasidrani v lipidno membrano, določajo njeno selektivnost in tako prepuščajo v organel samo tisto, kar je potrebno za nek proces v organelu.
Pravkar opisani princip kompartmentalizacije naj bi odigral eno ključnih vlog pri razvoju kompleksne evkariontske celice. Ločitev prostora v celici z lipidno membrano omogoča koncentriranje določenih komponent in ustvarjanje lokalnih pogojev, ki so pomembni za določen proces. Navedimo za primer zgolj lizosom, ki je namenjen razgradnji celičnih komponent. Hidrolitični encimi v lizosomu delujejo optimalno samo v kislem okolju, zato protonske črpalke, ki so zasidrane v lipidni membrani lizosoma, omogočajo stalno kislo okolje znotraj lizosoma. Takšno okolje bi lahko poškodovalo druge celične komponente v citoplazmi, zato prav razmejitev z lipidno membrano omogoča razmejitev funkcij, procesov in fizikalintrinokemijskih potreb določenih celičnih komponent.
Ta ustaljeni pogled kompartmentalizacije procesov v celici se je nedavno dodobra zasukal. Celični biologi in biologinje so namreč že dolgo opozarjali, da lahko v celicah poleg klasičnih organelov često opazimo nekakšne prehodne, začasne skupke nagnetenih molekul, ki so podobne običajnim membranskim organelom, le da niso zamejeni z lipidno membrano. Takšne skupke so raziskovalci in raziskovalke sprva pripisovali eksperimentalnim artefaktom. Ti naj bi nastali kot posledica sredstev za fiksiranje ali barvil, ki jih dodajajo vzorcem pred mikroskopiranjem. Z modernejšimi tehnikami mikroskopije so kasneje dognali, da takšni skupki niso zares povezani z eksperimentalnimi artefakti, ampak so funkcionalni biološki organeli brez lipidnih membran.
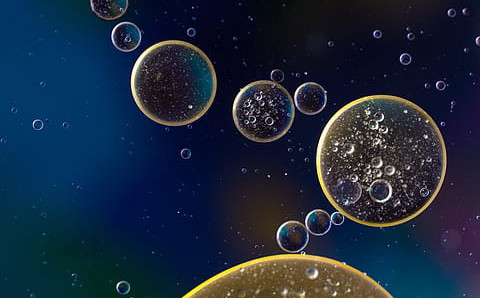
Takšni nemembranski organeli nastanejo zaradi združevanja bioloških makromolekul, kot so proteini in nukleinske kisline, torej molekule RNK in DNK. Pod mikroskopom jih prepoznamo kot sferične, optično goste objekte, pravzaprav kot kapljice. Da bi bolje razumeli, kako lahko nastane takšna biomolekularna kapljica v celici, se moramo zateči v svet biofizike. Zato smo na pomoč poklicali kvantitativno celično biologinjo, profesorico Amy Gladfelter z Univerze v Severni Karolini na Chapel Hillu. V nadaljevanju bomo z njeno pomočjo spoznali molekularne podstati procesa fazne ločitve tekoče-tekoče, ki omogoča tvorbo nemebranskih organelov v celici. V drugem delu oddaje, ko se bomo osredotočili na vlogo nemembranskih celičnih organelov v človeški fiziologiji in patofizologiji, pa nam bo z razlago pomagal molekularni biolog, profesor Boris Rogelj z Instituta »Jožef Stefan«.
Pri nastanku nemembranskih organelov torej sodelujejo proteini in nukleinske kisline. Ti interagirajo na specifičen način prek različnih interakcijskih motivov, ki so zakodirani v aminokislinskem zaporedju proteinov oziroma v nukleotidnem zaporedju nukleinskih kislin. V takšnih interakcijah so udeležene predvsem funkcionalne skupine na stranskih verigah aminokislinskih ostankov. Najlažje si je predstavljati interakcijo med nabitimi aminokislinskimi ostanki, ki so tudi sicer v veliki meri odgovorni za nastanek fazno ločenih kapljic. Negativno nabit aminokislinski ostanek glutamat se bo denimo raje zadrževal v bližini pozitivno nabitega ostanka lizina. Podobne odnose lahko opišemo tudi pri drugih parih aminokislinskih ostankov in vsakemu od njih pripišemo interakcijski potencial, ki določa, kako ugodna je interakcija med dvema aminokislinskima ostankoma.
Prav te medmolekulske interakcije, ki jih posredujejo proteini, in združevanje proteinov spodbujajo sistem k takšnim biomolekularnim skupkom. Gonilne sile za nastanek takšnih kondenzatov podrobneje opiše profesorica Amy Gladfelter.
Za medmolekulske interakcije, ki biomolekularni sistem spodbujajo v fazno separacijo, je torej značilna visoka stopnja nereda, ki ga povzročajo intrinzično neurejene regije proteinov. Tem smo sicer že namenili eno prejšnjih oddaj, a ne bo škodilo, če nekoliko obnovimo znanje. Intrinzično neurejeni proteini so tisti, ki zaradi specifične aminokislinske sestave oziroma zaporedja nimajo stalne tridimenzionalne strukture, so zelo fleksibilni in v raztopini hitro preklapljajo med različnimi energetsko ekvivalentnimi konformacijami. Za takšna zaporedja sta značilni tudi sekvenčna osiromašenost in enostavnost. Kljub temu pa ta zaporedja vsebujejo nekatere pomembne sekvenčne motive, ki omogočajo interakcije z drugimi komponentami v fazno ločeni kapljici. Kot je poudarila Gladfelter, je za interakcije značilna tudi multivalentna narava, saj mora biti takšnih interakcijskih motivov vzdolž zaporedja več. Z opisom nastanka fazno ločenega kondenzata nadaljuje Gladfelter.
Ob fazni ločitvi se proteini in nukleinske kisline zgnetejo v fazno ločeno kapljico, ki jo skupaj držijo prej opisane medmolekulske interakcije. Opažene lastnosti takšnih kapljic, v katere se oblikujejo kondenzati, po številnih kriterijih često ustrezajo opisu tekočine. Kapljice imajo tako kot pri drugih tekočinah sferično obliko. To je posledica površinske napetosti, ki prisili sistem k temu, da zavzame čim manjšo površino. Opazimo tudi, da se te kapljice ob trkih zlijejo, ob stiku s površino pa se odbijejo od nje. Opravka imamo torej s kapljico, ki jo obdaja druga tekočina; to je denimo v celici preostala citoplazma. Podoben pojav v vsakdanjem življenju opazimo pri razpršenih kapljicah olja v kisu. Iz te tekočine znotraj tekočine tudi izvira ime fazna ločitev tekoče-tekoče. A Gladfelter nas kmalu opozori, da v celici stvari vseeno niso tako enoznačne in da vsi proteinski kondenzati morda le niso tako tekoči.
Sledi kratek glasbeni premor, nato pa nekaj več o tem, kako raziskujemo biomolekularne kondenzate in s kakšnimi težavami se spoprijemajo raziskovalci in raziskovalke.
The Oscillations - Liquid Memoryman
Raziskovalci in raziskovalke se proučevanja biomolekularnih sistemov, pri katerih se lahko zgodi fazna ločitev, navadno lotevajo z izoliranimi komponentami zunaj celic, saj so eksperimentalni pogoji zunaj celice bolj nadzorovani. V epruveti torej zmešajo nekaj komponent opaženega nemembranskega organela in opazujejo, kdaj in pod kakšnimi pogoji se fazna ločitev sploh zgodi. A v celici je stvar precej bolj zagonetna, zato je o nekaterih sistemih še zelo malo znanega. Vzroki so predvsem v težavah pri eksperimentalnem naslavljanju takšnih kondenzatov. Pojasni Gladfelter.
V resničnih nemembranskih organelih, kot je jedrce znotraj celičnega jedra, v katerem se denimo izgradijo ribosomi, je lahko v takšnem kondenzatu tudi do sto različnih proteinov. In prav ta kompleksnost otežuje raziskave in karakterizacije takšnih sistemov in vivo. Vendar so te še kako potrebne, saj se le z opazovanjem pojava v živem sistemu lahko prepričamo, da je ta zares biološko relevanten. Na pasti raziskovanja enostavnejših, izoliranih fazno ločenih sistemov nas opozori Gladfelter.
Eksperimentalna obravnava biomolekularnih kondenzatov in merjenje njihovih fizikalnih lastnosti sta, kot ste slišali, še v povojih. Tudi zato se selimo iz biologije v biofiziko. Zanima nas, kako takšne sisteme modeliramo in jih računalniško simuliramo.
V naslednjih minutah oddaje Frequenza della scienza bomo spoznali biofizikalna teoretična pomagala, s katerimi skušamo razumeti pojav biološke fazne ločitve. Tu se staknemo s področjem statistične mehanike, ki skuša naše znanje o snovi povezati z njeno delčno naravo — tekočina, čeprav se na prvi pogled zdi homogena, je navsezadnje sestavljena iz molekul. Pri takšnem pristopu imamo dva cilja: po eni strani reducirati biološki sistem na najmanjše število pomembnih prostostnih stopenj, po drugi pa prevesti problem v sistem matematičnih enačb, ki jih lahko reši računalnik.
Pri tem nam za izhodišče služi Isingov model, ki je bil prvotno namenjen opisu in razumevanju ureditve magnetnih polj posameznih atomov v feromagnetni fazi denimo železa ali niklja. Predstavljajmo si šahovnico, ki jo zapolnimo s figurami dveh barv tako, da je na vsakem polju ena figura, število figur ene in druge barve pa je enako. Nato vsakemu paru figur na dveh sosednjih poljih pripišemo energijo. Dve sosednji rdeči figuri imata denimo medsebojno energijo 0, dve sosednji zeleni minus 1, dve različnih barv pa plus 1. Stanje z najnižjo energijo je v tem primeru tisto, pri katerem vse rdeče figure tvorijo en otok, saj tako minimizirajo število energijsko neugodnih sosednjih parov z različno obarvanima figurama.
Če v opisani situaciji interpretiramo figure ene in druge barve kot delce različnih tekočin, smo že dobili minimalni model fazne ločitve. V tem primeru sta obe tekočini enostavni v smislu, da so gradniki brez posebne oblike. Ta model lahko nadgradimo v opis zmesi dveh tekočin, od katerih je topilo sestavljeno iz enostavnih molekul, druga tekočina pa iz dolgih polimerov oziroma verig posameznih molekul. Tako se bolj približamo razmeram, ki botrujejo nastanku kapljic proteinskega kondenzata.
Posplošitev dosežemo enostavno tako, da rdeče figure povežemo v verige določene dolžine. Podobno kot v Isingovem modelu nato primerjamo energijsko in entropijsko ugodnost kondenzirane faze, pri kateri so vsi rdeči polimeri zbrani v skupek, ali dobro zmešane faze, pri kateri so ti polimeri enakomerno porazdeljeni med molekule topila. Pokaže se, da kondenzirano fazo stabilizira zgolj en parámeter, ki meri razliko energij za soseda iste ali različne vrste in ga označimo z grško črko ki. Opisani model poznamo kot Flory-Hugginsov model tekočine. Model sicer vsebuje pomembno predpostavko povprečnega polja, kar pomeni, da za okolico vsakega polimera privzame povprečno gostoto polimera v topilu.
Od tega poenostavljenega modela zmesi dveh tekočin sicer ne moremo pričakovati, da bo kvantitativno ustrezal opisu razmer v živih celicah. Kot smo omenili, pri nastanku proteinskih kapljic običajno sodeluje mnogo različnih polimernih molekul, ki med sabo tvorijo na stotine interakcij, poleg tega pa jih v komplekse povezujejo še krajše molekule RNK. O tem, kje so omejitve pri spopadu s kompleksnostjo na siliciju, smo vprašali tudi Gladfelter.
Razširjena metoda biofizikalnega modeliranja je molekulska dinamika, pri kateri numerično izračunamo časovni razvoj določene začetne konfiguracije atomov vključno z valenčnimi elektroni in njihovim električnim poljem. Resnični proteinski kondenzat pa je preveč kompleksen, da bi lahko na ta način zaobjeli vse njegove sestavine. Kljub temu nam poenostavljeni modeli lahko nudijo vpogled v pomen nekaterih skrbno izbranih elementov sistema in trenja med njihovimi težnjami. Nadaljuje Gladfelter.
Še vedno poslušate oddajo Frequenza della scienza na valovih Radia Študent, v kateri se danes tekočine med seboj ne mešajo, temveč ustvarjajo prav posebne biomolekularne celične kompartmente. Prvi del oddaje smo posvetili biofizikalnemu vidiku nastanka biomolekularnih kondenzatov, v nadaljevanju pa sledi bolj funkcionalni del o tem, kje najdemo takšne kondenzate in kaj ti počnejo ali povzročajo.
Z leti so znanstveniki in znanstvenice odkrivali vedno več nemembranskih celičnih organelov. Čeprav se je sprva zdelo, da gre za trdne tvorbe v tekoči citoplazmi, pa smo v oddaji že spoznali tekočo in dinamično naravo teh struktur. Pomen fazne ločitve za tvorbo nemembranskih organelov je leta 2009 prva pokazala znanstvena skupina pod okriljem Clifforda Brangwynna, ki je proučevala citoplazemske strukture v zarodnih celicah modelnega organizma C. elegans, imenovane granule P. Nadaljnje raziskave so pokazale, da je velika večina fazno ločenih predelkov v celicah sestavljena iz molekul RNK in proteinov, ki vežejo RNK. Kako taka sestava omogoča nastanek kondenzatov, nam slikovito razloži doktor Boris Rogelj.
Rogelj našteje še nekatere celične procese, pri katerih se tvorijo biomolekularni kondenzati.
Biomolekularni kondenzati imajo torej pomembno vlogo v številnih celičnih procesih, a Gladfelter opozori, da njihova funkcija še zdaleč ni omejena zgolj na celično raven, temveč lahko poseže tudi na raven organizma.
Fazno ločeni kondenzati tako učinkujejo kot svojevrstni fizikalnokemijski detektorji, ki so zelo občutljivi za spremembe razmer v okolju. Kot omeni Gladfelter, lahko razpad in nastanek takšnih kondenzatov - denimo ob povišani temperaturi - uravnava celo cvetenje rastlin.
A vrnimo se k celici. Vidimo, da je fazna ločitev v celicah integralen fiziološki proces. Čeprav je najbolj opazna v nemembranskih organelih, se dogaja pri tako rekoč vseh celičnih procesih. Najdemo jo, na primer, pri izražanju genov in celičnem signaliziranju, prav tako pa se lahko z nastankom kondenzatov ustvarijo ustrezni pogoji za potek različnih encimskih reakcij.
Vendarle pa se včasih zgodi, da integralni biološki procesi ne potekajo po načrtu. Številne raziskovalne skupine so v zadnjem desetletju odkrile povezavo med fazno ločitvijo in nekaterimi patologijami, kot so névrodegeneratívne bolezni. Tako imenujemo skupino bolezni, za katere je značilen propad nevronov. Najbolj znani sta verjetno Alzheimerjeva in Parkinsonova bolezen, vendar še zdaleč nista edini. Prav gotovo se vsi spomnimo slavne kampanje Ice bucket challenge, ki je pred nekaj leti ozaveščala o amiotrofični lateralni sklerozi, krajše ALS, za katero je sicer zbolel tudi Stephen Hawking. Pri tej bolezni so prizadeti motorični nevroni, kar najprej onemogoči gibanje, kasneje pa tudi osnovne dihalne funkcije.
Skupna značilnost nevrodegenerativnih bolezni je nastanek trdnih proteinskih agregatov. Mehanizem nastanka takšnih tvorb je še precej neraziskan, a trenutno prednjači teorija, da netopni agregati nastanejo s procesi fazne ločitve. Rogelj razloži, kaj vse vpliva na prehod kondenzatov v trdne agregate.
Največkrat se nastanek netopnih agregatov povezuje s pojavom že omenjenih stresnih granul. Dolgotrajen celični stres ali nezmožnost celic, da raztopijo stresne granule, lahko povzročita fazni prehod tekočih granul v trdne agregate. Znanstvene skupine so večkrat opazile ta pojav pri proučevanju patoloških mehanizmov amiotrofične lateralne skleroze. Pri tej bolezni se v agregatih najpogosteje pojavlja protein TDP-43. Kakšna je povezava med agregacijo tega proteina in stresnimi granulami?
Opazimo lahko, da kljub znanstvenemu konsenzu o vplivu tekočih proteinskih kapljic na tvorbo agregatov številna vprašanja o mehanizmih nevrodegeneracije ostajajo neodgovorjena. To najbolje oriše pereča tematika vloge agregatov v patologiji nevrodegeneracije. Niti njihova toksičnost namreč ni samoumevna, saj bi lahko šlo za mehanizem, s katerim se celica obvaruje pred bolj toksičnimi molekulami. V tem primeru bi bil sam agregat nekakšno smetišče za nevarne odpadke, kamor celica odloži toksične proteine. Tvorba agregatov za celico v nobenem primeru ni optimalna, vendarle pa bi bila lahko nekakšen zadnji poskus rešitve, ki celice do neke mere obvaruje. Povod za takšno razmišljanje predstavi Rogelj.
Večina znanstvene sfere se kljub temu nagiba k toksičnosti agregatov. Številne raziskovalne skupine tako iščejo načine, kako bi te tvorbe razgradili. Poznavanje temeljnih mehanizmov fazne ločitve in agregacije pa bi lahko omogočilo tudi preprečevanje nastanka agregatov. Takšne metode bi bile lahko v prihodnosti eden od načinov zdravljenja nevrodegenerativnih bolezni.
Kot disagregaze torej lahko uporabimo različne molekule, od proteinov do RNK in manjših organskih molekul. Številne takšne molekule v laboratorijih že kažejo velik potencial. Vendarle pa smo v oddaji spoznali, da imata fazna ločitev in tvorba tekočih kondenzatov integralno vlogo v celično-bioloških procesih. Z vnosom disagregaz lahko tako hkrati vplivamo na ključne biološke funkcije.
Z razgrajevanjem patoloških agregatov proteina TDP-43 smo priplavali do konca oddaje. Pred zaključkom smo doktorico Amy Gladfelter še vprašali, kako je odkritje biološkega pomena nemembranskih organelov in njegovih molekularnih osnov vplivalo na naš pogled na celično biologijo in kakšne izzive prinaša novo znanje za medicinsko uporabo.
Spoznanje, da v celici obstajajo drugi mehanizmi kompartmentalizacije in organiziranosti bioloških procesov v nemembranskih organelih, torej osnuje novo paradigmo za razumevanje organiziranosti celičnih procesov. Raziskovalna vprašanja, ki jih odpira novo polje, segajo od osnovnih biofizikalnih dilem glede dinamike proteinov v celici do regulacije fiziologije, povezane s to dinamiko. Kot smo predstavili v oddaji, je horizont teh mehanizmov obširen in še ne povsem določen. Interdisciplinarnost, ki je potebna za raziskovanje teh pojavov, pa oblikuje nove načine sodelovanja med biološkimi in fizikalnimi znanostmi. Vsekakor je to področje, ki se mu bomo posvečali tudi v prihodnje.
Tekočine smo mešali Luka, Martin in Uroš.
Brala sva Pia in Benjamin.
Tehniciral je Borut.
Lektorirala je Višnja.
*Popravek: Raziskovalna skupina pod okriljem Clifforda Brangwynna ni proučevala telesc P, temveč granule P, citoplazemske strukture v zarodnih celicah C. elegans.










Dodaj komentar
Komentiraj